INTRODUCCIÓN.
Las sustancias químicas tienen composición y propiedades definidas. Pueden ser simples o compuestas: las primeras están formadas por átomos de un sólo elemento químico (por ejemplo: oxígeno, O2); las sustancias compuestas están formadas por átomos de dos o más elementos químicos unidos químicamente en proporciones determinadas (por ejemplo: dióxido de carbono, CO2).
Las fórmulas químicas expresan la composición de las sustancias. La fórmula molecular indica el número exacto de átomos de cada elemento que están presentes en la unidad más pequeña de una sustancia. Por ejemplo: la fórmula molecular del dióxido de carbono CO2 indica que en la unidad más pequeña del mismo hay 1 átomo de carbono y 2 átomos de oxígeno.
Nota: los subíndices numéricos colocados del lado derecho del símbolo del elemento químico indican la atomicidad del mismo: el número de átomos de cada elemento que están presentes (en el dióxido de carbono es: 2 para el O y 1 para el C, el 1 no se coloca).
Para los
compuestos iónicos las fórmulas químicas en general son las mismas que las
fórmulas empíricas. Éstas indican cuáles elementos químicos están presente y
la proporción mínima entre sus átomos y no es necesariamente el número real en
una sustancia determinada. Por ejemplo para el peróxido de hidrógeno: fórmula empírica es HO y la fórmula química es
Los gases nobles tienen el último nivel energético completo lo cual explica la escasa reactividad química, su estabilidad, su existencia como gases monoatómicos. La estabilidad máxima de un átomo de un elemento químico se logra cuando es isoeléctrico con el gas noble más próximo en la tabla periódica: por eso los átomos interaccionan ganando, perdiendo o compartiendo electrones para alcanzar la misma cantidad de electrones que el gas noble más cercano.
Esas interacciones explican las fórmulas químicas de las sustancias. En general a las fuerzas que mantienen unidos a los átomos que forman una sustancia química se les llama enlaces químicos y hay varios tipos principales. Veremos a continuación los enlaces iónicos y covalentes.
ENLACE IÓNICO.
En los compuestos iónicos los átomos se unen por atracción de iones de cargas opuestas y a la fuerza electrostática que los mantienen unidos se denomina enlace
iónico. Este enlace se da principalmente al interaccionar átomos de un metal y un no metal. La interacción se puede explicar por la transferencia simultánea de electrones del metal al no metal: el metal pierde electrones y se transforma en un ion con carga positiva (un catión) y el no metal gana electrones transformándose en un ion con carga negativa (un anión). A su vez por tener cargas opuestas los iones formados se atraen eléctricamente y se unen entre sí formado la sustancia iónica. Nota: la cantidad de cationes y aniones formados son iguales por lo cual la sustancia es eléctricamente neutra (la suma total de cargas es 0).
En general los compuestos iónicos: son sólidos a temperatura ambiente y tienen altos puntos de fusión; son solubles en agua e insolubles en otros solventes; en estado sólido no conducen la corriente eléctrica pero si lo hacen al disolverse en agua o fundirse (los iones se liberan de la posición ocupada en la red cristalina sólida).
Veamos algunos ejemplos de sustancias iónicas y la explicación del enlace empleando las representaciones de Lewis.
El fluoruro de litio es un polvo blanco venenoso usado para disminuir el punto de
fusión de la soldadura y en la fabricación de cerámica. Su fórmula química, LiF, se explica mediante la unión por atracción electrostática de iones con cargas opuestas. El enlace lo podemos describir mediante el esquema que muestra la imagen siguiente:
Vemos que: los átomos de litio, Li, pierden 1 electrón transformándose en un ion con carga positiva (el catión litio); los átomos de flúor ganan 1 electrón transformándose en un ion con carga negativa (anión fluoruro); por último los iones positivos y negativos producen el enlace iónico mediante atracción electrostática entre ellos.
Notas:
- Normalmente se escribe la fórmula química del compuesto iónico sin mostrar las cargas, LiF, en este caso.
- Los átomos de Li al perder 1 electrón quedan con la misma cantidad de electrones (2) del helio que es el gas noble más próximo en la tabla periódica y alcanzan la estabilidad química.
- Los átomos de F al ganar 1 electrón quedan con la misma cantidad de electrones (10) del neón que es el gas noble más próximo en la tabla periódica y alcanzan la estabilidad química.
El óxido de calcio se conoce con el nombre de “cal viva”. Se trata de un compuesto iónico ampliamente usado desde la antigüedad en materiales de construcción, en albañilería, en la fabricación de morteros, etc. Se obtiene mediante calcinación de rocas calizas en forma de piedras y su fórmula química es CaO. Los átomos de calcio ceden 2 electrones: se transforman en catión Ca con carga +2 y así queda con 18 electrones (la cantidad que tiene el gas noble más próximo: el argón). Por su parte: los átomos de O también alcanzan la cantidad de electrones del Ar al ganar 2 y transformarse en el anión correspondiente con carga -2. Por atracción electrostática entre el catión y el anión se forma el compuesto iónico CaO. El esquema muestra el proceso descripto:
Nota: para
representar el enlace covalente (los pares de electrones compartidos) se
acostumbra emplear una línea.
Encontramos 2 tipos de enlaces covalentes: covalente no polar o apolar y covalente polar (se describen brevemente más adelante).
Las
sustancias que presentan enlaces covalentes se denominan sustancias moleculares
y en general cumplen con las siguientes características: tienen puntos de
fusión más bajos que los compuestos iónicos;
no son solubles en agua y sí en solventes orgánicos; no conducen la
corriente eléctrica.
Veamos
algunas sustancias que presentan enlace covalente.
El flúor es un gas a temperatura ambiente, de color verde pálido, formado por moléculas diatómicas de fórmula química F2. La formación de la molécula la podemos representar
las estructuras de Lewis de la siguiente manera:
Observamos que cada átomo de flúor presenta 3 pares de electrones libres que no participan en la formación del enlace y 1 electrón libre que será compartido para formar el enlace covalente. De esa manera los átomos de F alcanzarán la distribución electrónica del gas noble más cercano (el Ne en este caso que posee 10 electrones).El ácido clorhídrico, HCl, es el principal componente del jugo gástrico en el ser humano y tiene muchas otras aplicaciones (industriales, comerciales, etc.). Su fórmula química se explica mediante el enlace covalente formado por los electrones libres del H y del Cl:
Así (compartiendo el electrón de valencia libre que presenta cada átomo) el H y el Cl alcanzan la cantidad de electrones del gas noble más próximo en la tabla periódica (He y Ar respectivamente).Nota. Recordemos las estructuras de Lewis de los elementos químicos participantes:
ELECTRONEGATIVIDAD
La
electronegatividad se define como la capacidad de un átomo de atraer hacia sí
los electrones de un enlace químico. Es un concepto relativo: sólo se puede
medir la electronegatividad de un elemento químico respecto de la de otros
elementos. Linus Pauling (1901-1994, químico estadounidense) desarrolló un
método para calcular las electronegatividades relativas, cuyos valores se
muestran en la siguiente tabla:
La electronegatividad
es una propiedad periódica: se relaciona con el carácter metálico de los
elementos y sus valores aumentan de izquierda a derecha en un período (los
elementos de transición no siguen esta tendencia) y en un grupo disminuyen al
aumentar el número atómico.
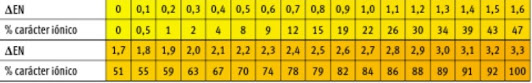
La diferencia de electronegatividades (representada por ΔEN) entre los átomos que participan de un enlace químico es útil para predecir el tipo de enlace. La figura nos muestra el porcentaje de carácter iónico con la variación de ΔEN:
Si bien no hay una distinción tajante entre enlace covalente y enlace iónico podemos adoptar algunos valores para predecir el tipo de enlace.
- Cuando la diferencia de electronegatividad entre los átomos de los elementos químicos que participan del enlace químico es 2,0 o más se formará un enlace iónico.
Los
cálculos de diferencia de electronegatividad para los ejemplos vistos anteriormente
son:
Fluoruro de
litio: ΔEN= ENF-ENLi=4,0-1,0=3,0
Óxido de
calcio: ΔEN= ENO-ENCa=3,5-1,0=2,5
Óxido de litio: ΔEN= ENO-ENLi=3,5-1,0=2,5
Los resultados obtenidos son mayores que 2,0 lo cual predice que la unión entre los átomos se da por enlace iónico.
Aclaración:
la diferencia de electronegatividad es un valor positivo o cero (al valor mayor
se le resta el menor).
- Cuando los átomos son idénticos (como en el caso de la molécula de F2 vista) la diferencia de electronegatividad ΔEN=0 (haciendo el planteo en el ejemplo: ΔEN=ENF-ENF=4,0-4,0=0) y los electrones se compartan de manera equitativa (pasan el mismo tiempo alrededor de cada átomo, o dicho de otra manera: la distribución de cargas entre los átomos es uniforme). La molécula de F2 es un ejemplo en la cual se produce un enlace covalente apolar.
En general
cuando la diferencia de electronegatividad entre los átomos tiende a 0 podemos
inferir que de dará un enlace covalente apolar y una buena aproximación para
tomar esto como regla general es que el valor ΔEN quede comprendida entre 0 y
0,4.
El metano, de fórmula química CH4 y cuya representación de Lewis se muestra, es un hidrocarburo. Para esta molécula: ΔEN= ENC-ENH=2,5-2,1=0,4, valor que sugiere un enlace químico covalente apolar entre los átomos de C e H.
- El enlace covalente polar ocurre cuando ΔEN aumenta, aumentando así el porcentaje de carácter iónico. Si bien no hay un valor exacto de diferencia de electronegatividad que permita predecir cuál enlace covalente ocurre, en general una buena aproximación sería indicar que un enlace covalente polar se da cuando la diferencia de electronegatividad es mayor que 0.4 y tiende a 1,7. En este caso se unen átomos de elementos de diferente electronegatividad y el par de electrones compartido será atraído por los átomos del elemento más electronegativo. Dicho de otra forma: en la molécula los electrones del enlace se distribuyen de manera desigual (podemos pensar que están más tiempo alrededor del átomo más electronegativo).
En consecuencia la molécula resultante de la unión mediante este enlace es polar: alrededor del átomo más electronegativo hay una zona de elevada densidad de carga negativa al tiempo que sobre el átomo menos electronegativo queda con densidad de carga positiva.
Para la molécula de ácido clorhídrico, HCl, señalada anteriormente, la diferencia de electronegatividad es: ENCl-ENH=3,0-2,1=0,9 lo cual indica que ocurre un enlace covalente polar y los electrones del enlace serán más atraídos por los átomos de cloro que de hidrógeno dado que son más electronegativos. Asimismo sobre los átomos de cloro habrá una densidad de carga negativa y sobre los átomos de hidrógeno una densidad de carga positiva.
El amoníaco es una sustancia molecular de amplios usos y de fórmula química: NH3. La figura muestra una representación (espacial en este caso) de la molécula: se señalan los enlaces entre los átomos de N e H y mediante la letra griega delta minúscula y los signos menos y más la densidad de cargas sobre cada átomo lo cual se corresponde con el concepto de enlace covalente polar. Para esta molécula la diferencia de electronegatividad es: ΔEN= ENN-ENH=3,0-2,1=0,9, valor que sugiere un enlace covalente polar.